省药监局正式发布《中药饮片不符合药品标准,尚不影响安全性、有效性的认定指导意见》
鲁网5月6日讯 4月27日,山东省药品监督管理局印发《中药饮片不符合药品标准,尚不影响安全性、有效性认定指导意见》(以下简称《意见》),规范中药饮片案件办理,统一中药饮片不符合药品标准、尚不影响安全性、有效性判定的尺度。
据悉,新修订《药品管理法》第一百一十七条第二款明确规定,“生产、销售的中药饮片不符合药品标准,尚不影响安全性、有效性的,责令限期改正,给予警告”。这一规定充分考虑到了中药饮片多样性及复杂性等特殊性。但是,山东省目前在执法实践中对于如何把握“尚不影响安全性、有效性”尚无统一规定。对于如何适用该款,中药饮片生产企业呼声高,系统内要求迫切。为此,山东省药监局在充分调研论证的基础上起草了《意见》。
《意见》共十二条,仅适用于新修订《药品管理法》第九十八条第三款第七项规定的“其他不符合药品标准的药品”的认定,主要规定了影响安全性有效性的项目、不影响安全性有效性项目及限量值、特殊情形认定以及不合格品处置等方面的内容。
对于是否影响安全性、有效性,《意见》主要考虑两个因素:是否属于药品标准规定的影响中药饮片质量的关键指标,如特征图谱/指纹图谱、含量测定等;是否属于药品标准规定的风险较高的项目,如重金属及有害元素、农药残留量等。
在对不影响安全性、有效性项目的认定上,《意见》仅规定了性状、杂质、水分、灰分四个项目,并明确相应的具体限量值。同时,依据本意见认定不影响安全性、有效性的中药饮片,不改变其不符合药品标准规定的结论。生产经营企业应当分析不合格原因,并采取相应的纠正预防措施。对符合上述条件的不合格品,《意见》提出处置要求:对性状、杂质、水分、灰分超出限度,尚不影响安全性、有效性的中药饮片,生产企业可以对同一批次产品进行净制、切制、干燥等返工处理,委托市级以上药品检验机构检验合格后可以出厂。这既能有效落实“四个最严”规定,又能在确保药品安全的基础上,最大程度地保障中药饮片企业合法利益。
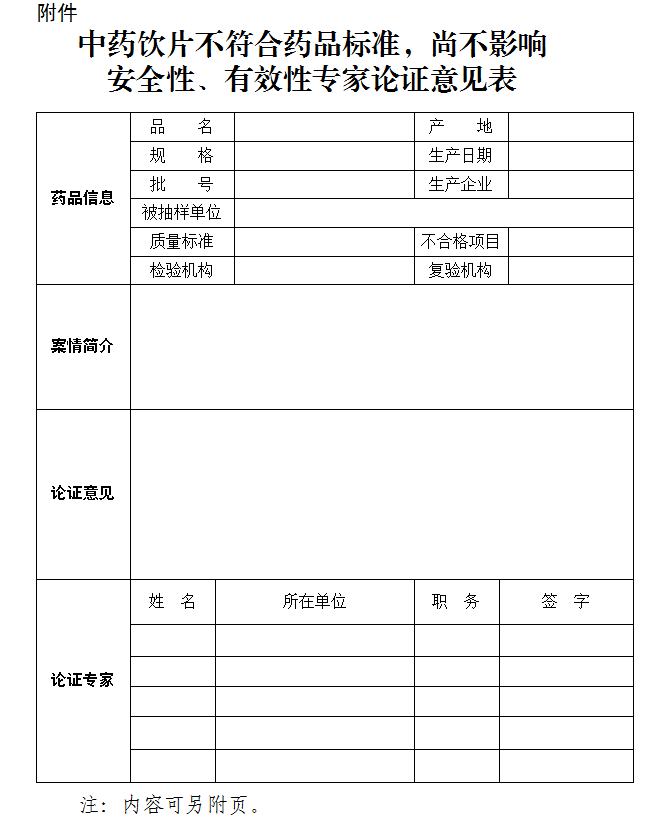
为避免挂一漏万,《意见》对特殊情形进行了认定:如遇到本意见未涉及、特殊品种难以认定等情形,案件承办机构应当组织中药质量控制、临床实践、生产炮制、法律等领域的专家论证,依据本意见精神对是否构成“尚不影响安全性、有效性”进行认定。专家论证意见及相对应的行政处罚决定书每半年上报省药品监督管理部门。
此外,《意见》还将以合成、提取加工、人工配制中药材炮制成中药饮片,违法添加防腐剂、染色增重物质、辅料或其他物质以及其他故意违法等情形排除在不影响安全性有效性的情形之外,从而有效避免企业将《意见》作为“避风港”,借此逃避处罚。
中药饮片不符合药品标准,尚不影响安全性、有效性认定指导意见
第一条 为规范我省中药饮片案件办理,统一中药饮片不符合药品标准,尚不影响安全性、有效性判定的尺度,根据《中华人民共和国行政处罚法》《中华人民共和国药品管理法》等法律法规规章和药品标准规定,制定本意见。
第二条 本意见仅适用于《中华人民共和国药品管理法》第九十八条第三款第七项规定的“其他不符合药品标准的药品”的认定。
依据本意见认定不影响安全性、有效性的中药饮片,不改变其不符合药品标准规定的结论。生产经营企业应当分析不合格原因,并采取相应的纠正预防措施。
第三条 有下列情形之一的,不适用《中华人民共和国药品管理法》第一百一十七条第二款:
(一)以合成、提取加工、人工配制中药材炮制成中药饮片的;
(二)违法添加防腐剂、染色增重物质、辅料或者其他物质以及其他故意违法的;
(三)其他依法不应当适用的情形。
第四条 通常认定影响中药饮片有效性的项目,包括但不限于鉴别、浸出物、特征图谱/指纹图谱、含量测定等。
通常认定影响中药饮片安全性的项目,包括但不限于二氧化硫残留量、重金属及有害元素、农药残留量、真菌毒素、直接口服及泡服饮片的微生物限度、毒性成分的限量检查等。
第五条 本意见所称“尚不影响安全性、有效性”的中药饮片检验项目限于性状、杂质、水分、灰分,当上述项目不符合药品标准规定时,可依据本意见认定其是否影响安全性或者有效性。当依据本意见认定其中任意一项不符合标准规定的结果影响了安全性或者有效性,即可认定为影响安全性、有效性。
第六条 在品种基原和药用部位正确的情况下,中药饮片的性状项目不符合药品标准规定,但符合以下情形的,可认定为尚不影响中药饮片的安全性、有效性:
(一)切制规格、形状、大小、厚薄等不符合药品标准规定,但省内有使用习惯或者临床有需求的;
(二)色泽不符合药品标准规定,但未超出规定色系且无其他不符合标准问题的。
第七条 中药饮片的杂质项(药屑及杂质)不符合药品标准规定,但符合以下情形之一的,可认定为尚不影响中药饮片的安全性、有效性:
(一)药屑及杂质标准在3%以下(含3%)的,实际药屑及杂质含量不超过6%;
(二)药屑及杂质标准为3%~8%的,实际药屑及杂质含量不超过10%。
第八条 中药饮片的水分项不符合药品标准规定,但符合以下情形之一的,可认定为尚不影响中药饮片的安全性、有效性:
(一)水分标准在13%以下(含13%)的,不超过标准值的20%;
(二)水分标准在13%以上的,不超过标准值的10%。
第九条 中药饮片的灰分项不符合标准规定,但符合以下情形之一的,可认定为尚不影响中药饮片的安全性、有效性:
(一)总灰分:总灰分标准在10%以下(含10%)的,不超过标准值的25%;总灰分标准在10%以上的,不超过标准值的15%;
(二)酸不溶性灰分:酸不溶性灰分在5%以下(含5%)的,不超过标准值的25%;酸不溶性灰分在5%以上的,不超过标准值的15%。
第十条 如遇到本意见未涉及、特殊品种难以认定等情形,案件承办机构应当组织中药质量控制、临床实践、生产炮制、法律等领域的专家论证,依据本意见精神对是否构成“尚不影响安全性、有效性”进行认定。专家论证意见及相对应的行政处罚决定书每半年上报省药品监督管理部门。
第十一条 对性状、杂质、水分、灰分超出限度,尚不影响安全性、有效性的中药饮片,生产企业可以对同一批次产品进行净制、切制、干燥等返工处理,委托市级以上药品检验机构检验合格后可以出厂。
第十二条 本意见自印发之日起施行,有效期5年。(本网记者)
- 2021年山东省“安全用药月”进社区活动成功举行2021-12-05
- 《山东省中药配方颗粒管理细则》出台 11月1日起施行2021-10-29
- 省药监管局印发《山东省药品质量抽查检验管理办法》6月1日起实施2021-05-08
- 山东省2021年全省药品市场监督检查计划公布 省级检查约430家次2021-04-06
- 山东出台促进中药产业高质量发展措施,4月1日起实施2021-03-16
- 中国医药物资协会企业大学揭牌成立2020-11-24
- 中国医药物资协会“全球千亿中医药产业合作联盟” 互联网B2B平台成功上线2020-11-17
- 《中医药法》实施两周年,国家政策引领珍宝岛中药现代化合规发展2019-07-04
- 中药饮片染色增重多家违法企业被查2012-09-10