中国首个阿柏西普生物类似药正式获批上市!眼底患者迎来新选择!

2023年12月18日,齐鲁制药有限公司研发的阿柏西普眼内注射溶液(卓初明®),正式获得国家药品监督管理局(NMPA)批准上市,用于治疗新生血管(湿性)年龄相关性黄斑变性(nAMD)、糖尿病性黄斑水肿(DME)的成人患者。值得一提的是,这是首个在中国上市的阿柏西普生物类似药。该产品的正式获批上市,标志着该款药物即将开启大规模临床应用新阶段,将有更多的眼底医生和患者因此获益,推动眼底病管理迈入新时代!
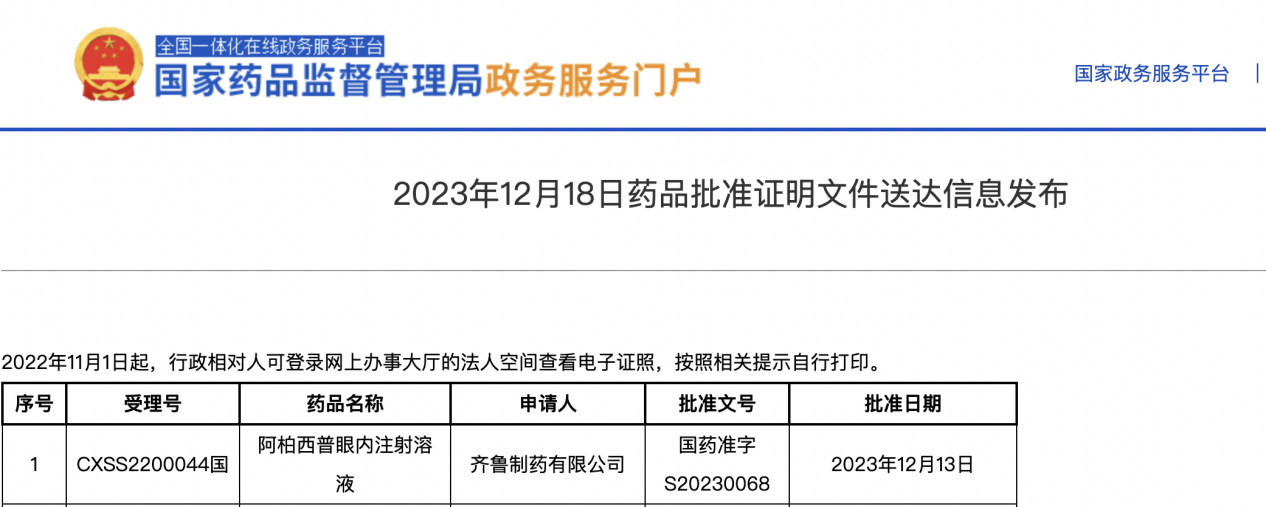
图片来源:中国国家药监局官网
—— 聚焦专家视角,见证荣耀时刻 ——
中国智造,为眼底病而生
惠延年教授:“生物类似药与仿制药不同,其生产过程复杂,均经过数年的研发以及巨大的研发投入,具有与原研药相似的质量、疗效和安全性。”
马志中教授:“生物类似药与原研药等效,且价格更优惠,阿柏西普生物类似药的上市必将促使人类进步,实现更广泛的医疗效果”
陈有信教授:“阿柏西普生物类似药的上市可喜可贺,不仅意味着中国生物制药的成熟发展,更大的提高中国患者治疗依从性和药物可及性,惠及广大的眼底病患者”
—— 我国是世界上盲和视觉损伤患者最多的国家之一 ——
眼底疾病治疗的新武器
目前我国致盲疾病中,眼底疾病是不可逆盲的首位病因,占全部致盲眼病的54.7%。随着全球人口老龄化进程和糖尿病发病率的不断提高,以nAMD和DME为代表的眼底病患病率也持续攀升,这对临床医患均造成了巨大的医疗压力和经济负担。我国以AMD和DME为主的眼底病治疗需求巨大,疾病负担重。
国内外指南均推荐抗VEGF药物是nAMD和DME的一线治疗选择,国内市场上以雷珠单抗、阿柏西普和康柏西普3种抗VEGF药物为主。与雷珠单抗、康柏西普相比,阿柏西普具有靶点更广、亲和力更强、作用时间更长等优点,同时卓初明®可增加临床用药的可及性和可负担性,使患者获得更多治疗机会,从而提高其生活质量。
—— 全球生物类似药如火如荼发展——
“齐领未来,卓尔不凡”
随着越来越多的原研生物药专利到期,在临床需求、医保控费等因素的共同推动下,生物类似药的研发已经成为全球热点,各国结合国情国力制定出台相关政策法规,加快生物类似药的生产制造。在全球,临床用药的可及性始终是政府和社会关注的焦点。在眼底领域,生物类似药的发展仍处于起步阶段。
欧盟是全球第一个建立生物类似药法律体系的地区,目前欧盟已为生物类似药建立了完整的监管框架,为全球生物类似药产业的发展提供经验。
美国食品药品监督管理局(FDA)一直在鼓励和加速生物类似物的批准。其生物类似药市场规模将超过欧盟,目前仍以生物创新药为主。
中国的生物类似药是“十年磨一剑”,我国生物类似药产品在研发数量居世界首位。阿柏西普生物类似药卓初明®的获批将助力我国眼底病迈向新阶段!
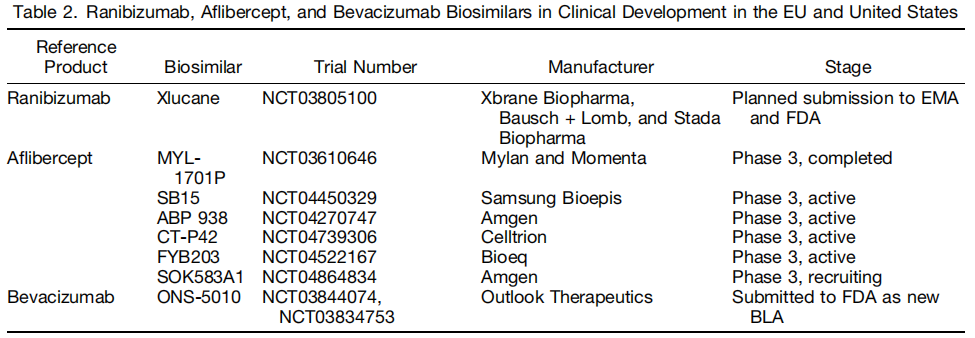
眼科的抗VEGF生物类似药
—— 卓效,安全,经济——
民族品牌值得信赖
卓初明®分子结构和氨基酸序列与原研药完全一致,它是重组人血管内皮生长因子受体-抗体融合蛋白,完整分子由2条相同的亚基组成,每条亚基包含432个氨基酸,其第1-102号氨基酸残基为人血管内皮生长因子受体1的第2个免疫球蛋白 (Ig) 结构域 (即VEGFR1 Ig2区)、第105-205号氨基酸残基为人血管内皮生长因子受体2的第3个Ig结构域 (VEGFR2 Ig3区)、第220-432号氨基酸残基为人lgG1的Fc结构域。

(图注:黄色:VEGFR1 Ig2区,灰色:VEGFR2 Ig3区,红色:半跳氮酸(C)之间的红色连接线表示二硫键的连接方式,蓝色:天冬酰胺(N),表示N-糖基化修饰位点)
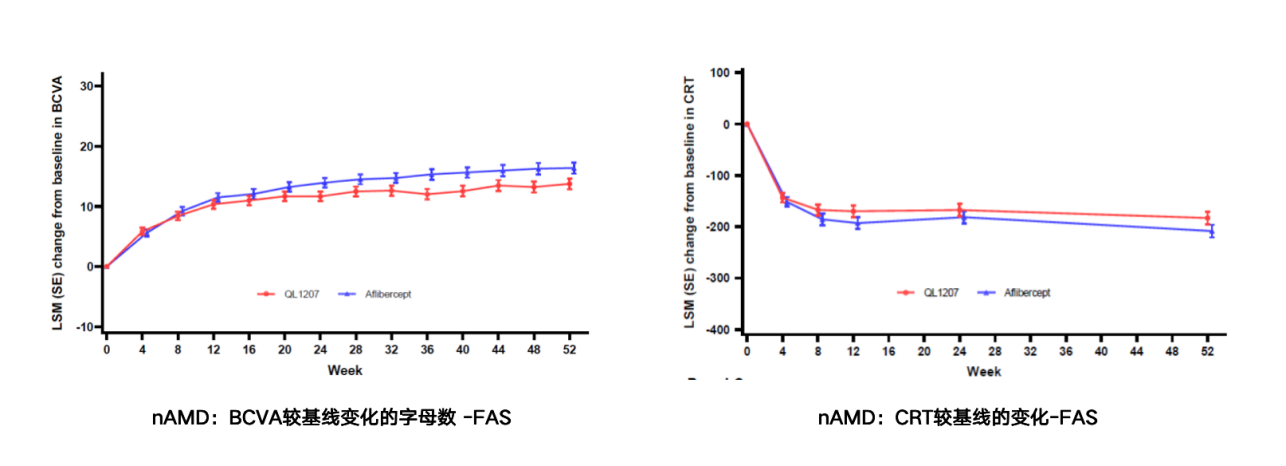
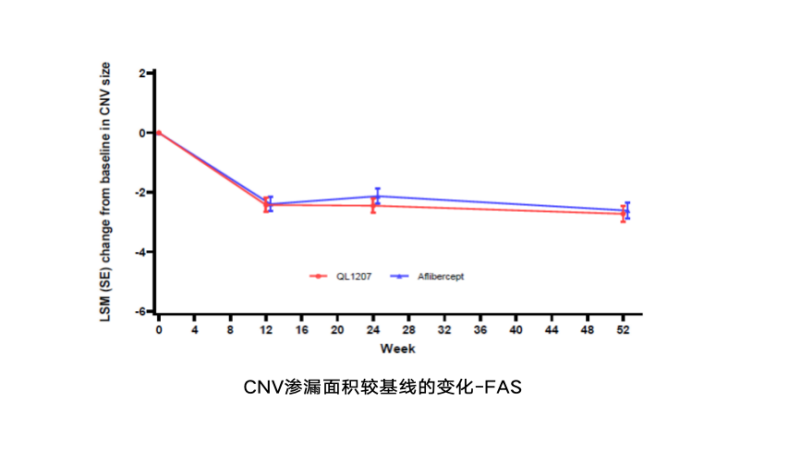
卓初明®一3期随机、双盲、平行、阳性对照研究,共纳入354例nAMD患者,评价卓初明®和艾力雅®的安全性和有效性,主要有效性终点为第12周BCVA较基线的变化;其它终点:CRT、CNV渗漏面积、TEAE、免疫原性、PK特征,为期54周。
nAMD患者在接受卓初明®治疗52周后,BCVA较基线改善约13.7个字母,且与原研药改善趋势一致。nAMD患者给药后CRT较基线下降约183µm,与原研药随时间变化趋势一致。给药后CNV渗漏面积均有所下降,且随时间变化趋势一致。
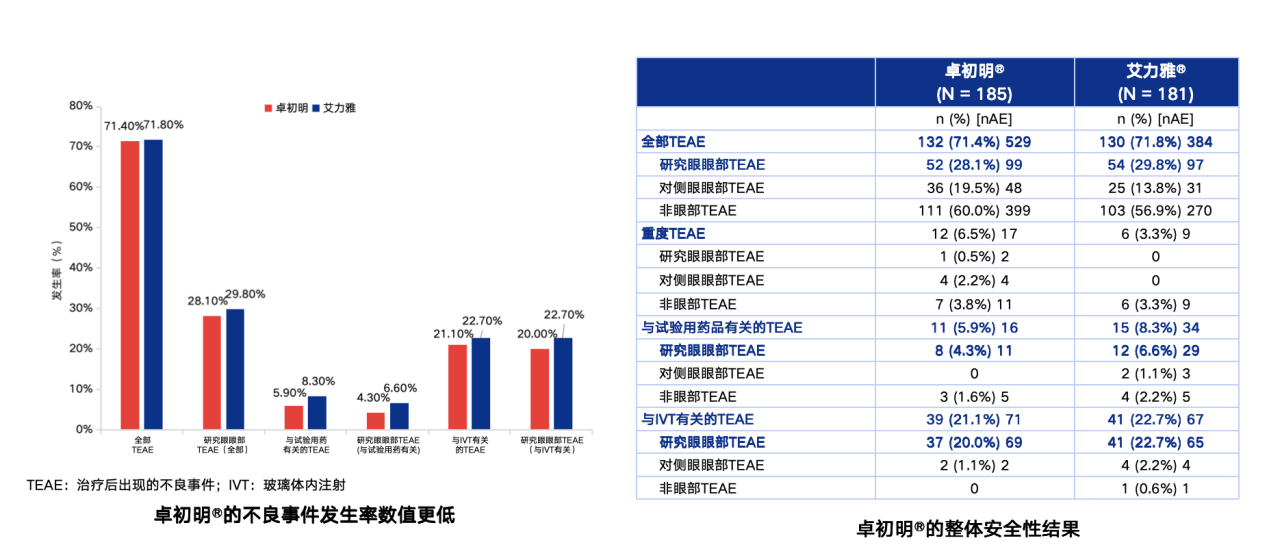
与原研药相比,卓初明®的不良事件发生率数值更低,纳入的所有患者均未发生眼内炎。
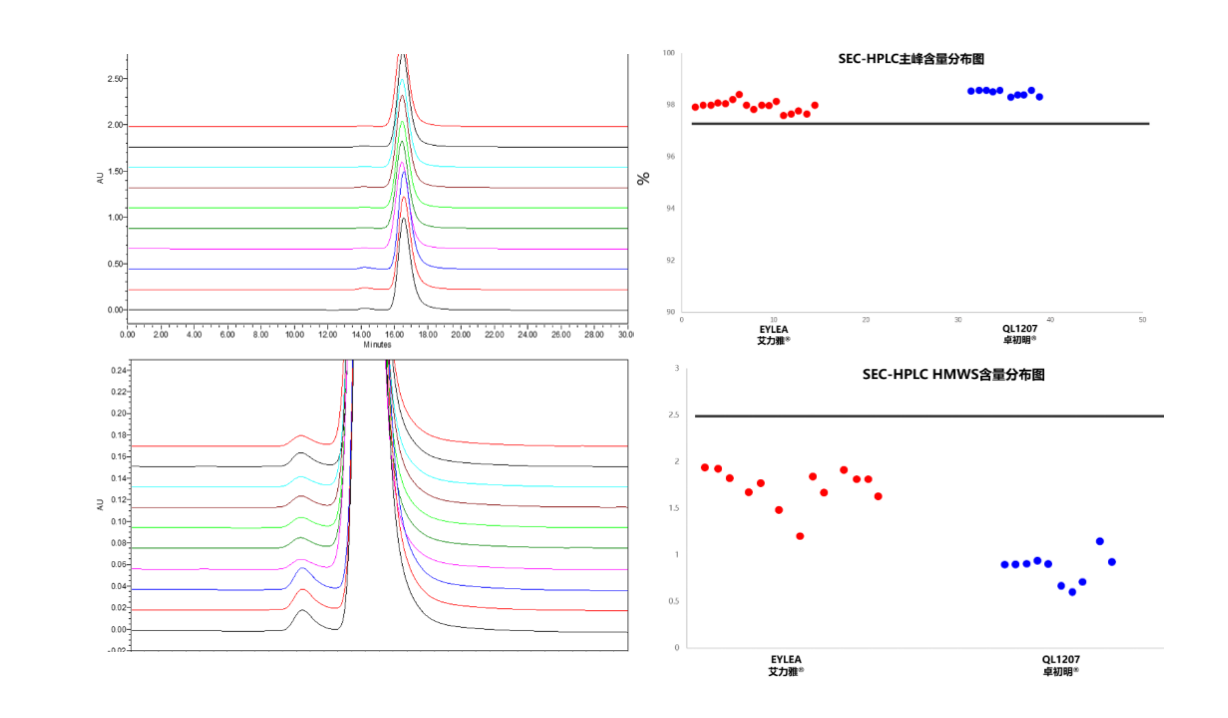
卓初明®的SEC-HPLC纯度约99%,还原CE电池纯度约97.7%,艾力雅®SEC-HPLC纯度约98%,还原CE电池纯度约93.3.7%,卓初明®药物纯度明显高于原研药,聚集体杂质低于原研药,并且处于较低水平。药物杂质与药物的质量、安全性、稳定性密切相关。药物的杂质控制对于保证药物的效能,降低药物的不良反应起着很关键的作用。
生物类似药的最大优点是节约费用,可减轻患者经济负担、降低医保负担,提高治疗依从性,并最终改善健康结果。一项研究结果显示, 约70%受访者认为抗VEGF生物类似药和原研药具有相似的有效性和安全性。91%受访者同意,生物类似药相对于原研药的主要优势是价格更低。此外,生物类似药与参比产品之间的价格竞争也可以降低参比产品的成本。
小结:随着生物类似药卓初明®正式获批上市,这对齐鲁制药及全体员工而言,既是对过往十年艰苦奋斗的一种诠释,也是又一新的征程,新的跨越的开始。卓初明®的上市将为眼底病治疗翻开新的篇章,以卓效助力眼底患者,共促健康中国宏伟蓝图的实现!
参考文献:
1.http://www.nhc.gov.cn/yzygj/s7653/202201/d607d24b6b1c4bd9b827eedf41eff820.shtml
2.刘延晶,王少鹏,徐喜卿,等. 人工智能诊断系统在基层眼底视网膜疾病筛查领域的应用实践[J]. 眼科学报,2023,38(5):405-413.
3.张朝阳,张敬香,张敬法.基因治疗在眼底血管性疾病中的应用和展望[J].国际眼科杂志,2023,23(03).
4.周瑾,杨晓姣,赵振宇.治疗视网膜黄斑病变的双特异性抗体:faricimab[J].中国新药与临床杂志,2023,42(07).
5.朱昶宇,童荣生.生物类似药在我国的用药管理挑战及对策探讨[J].中国医院药学杂志,2020,40(04):364-368.
6.Kaiser PK, et al. Retina.2022;42(12):2243-2250.doi:10.1097/IAE.0000000000003626.
7.Sharma A, et al. Expert Opin Biol Ther.2023;23(8):851-859.doi:10.1080/14712598.2023.2176218.